Противогрибковое действие и цитотоксический эффект in vitro эфирных масел и экстрактов медицинских и ароматических растений против Candida krusei и Aspergillus fumigatus
Julieth Correa-Royero; Verónica Tangarife; Camilo Durán; Elena Stashenko; Ana Mesa-ArangoЦель этого исследования состояла в том, чтобы оценить цитотоксический эффект и действие эфирных масел против C. krusei и A. fumigatus, in vitro. В дополнение, совместное действие итраконазола и амфотерицина B, и фармакодинамика самых активных образцов были оценены в случае с C. krusei по методу шахматной доски и кривых времени/уничтожения, соответственно.
Выбранные растения принадлежат к следующим родам: Salvia (S. aratocensis subsp. suratensis 516326, S. rubriflora Kunth 521064, S. amethystina J.E. Smith 521071, S. bogotensis Benth 521063, S. rubriflora Epling 521107, S. melaleuca subsp. totensis 521038, S. melaleuca subsp. melaleuca 521076, S. bogotensis 521074), Lippia (L. citriodora 484334, L. dulcis 512079, L. origanoides 512075, L. citriodora 480749, L. schlimii Turcz 521078), Lepechinia (L. salviifolia Kunth subsp. salviifolia 521070, L. conferta 521068), Hyptis (H. suaveolens (L) Poit 512267, H. perbullata 521095), Ocimum (O. campechianum 512263, O. tenuiflorum L. 516925), Croton (Croton spp. 519596, C. leptostachyus 519598), Lantana (L. camara 520293, L. fucata Lindl. 521031), Swinglea glutinosa 521530, Pimienta racemosa 512227, Siparum conica 519971, Nectandra acutifolia 520339, Calycolpus moritzianus 517006, Artemisia vulgaris L. 517002, Turnera aff. diffusa Willd. ex Schult. 516293, Rosmarinus officinalis 531011, Hedyosmum scaberrium Standl. 517321, Satureja brownei (Sw.) Briqn 519796, Aloysia tripilla 517189, Chenopodium ambrosioides L. 519592, Morella parvifolia (Benth) 517726, Schinus molle L. 517747, Calyptranthes sp. 517736, Bursera graveolens (Kunth) Triana & Planch. 517753, Cymbopogon citratus 531013, Aristolochia anguicida 512207, Morinda royoc L. 512222, Eugenia cf. uniflora 512226, Stachytarpheta mutabilis (Jacq) Vahl 512281, Calea glomerata 512231, Myrcia cucullata 512228, Tagetes lucida 512074, Hedyosmum racemosum 517005, Psychotria poeppigiana müll Arg. 512218, Phyllanthus acuminatus 512239, Eriope crassipes Benth 512260, Guatteria metensis 512205, Aristolochia ringens 512238, Coccocypselum hirsutum Bartl 519995, Alternanthera lanceolata 519981, Baccharis prunifolia 521077, and Sigesbeckia agrestis 521062.
MIC 23 активных образцов (GM<500 µg/mL), тестированных против C. krusei и A. fumigatus и соответственный значений IC50 представлен в Таблице 1. Шесть эфирных масел и три экстракта оказались действенны только против C. krusei (диапазон MIC GM 7.82 до 500 µg/mL), тогда как четыре эфирных масла и два экстракта были активны только против A. fumigatus (диапазон MIC GM 125 - 500 µg/mL). Семь масел и один экстракт имели обширный спектр действия, потому что они были активны против обоих штаммов. Нет никакого согласия относительно приемлемости растительных продуктов в сравнении со стандартными; поэтому некоторые авторы считают их действие лишь сопоставимым с антибиотиками, в то время как другие оценивают его даже выше (Hennebelle и др., 2008). Согласно классификации биологической активности, используемой Holetz и др. (2002), экстракт M. cucullata (MIC GM = 31.25 µg/mL) и масло C. ambrosioides L. (MIC GM = 7.82 µg/mL), проявили сильную активность против C. krusei. Действие обоих образцов было подобно или выше, чем у флуконазола, когда оно было оценено для десяти клинических изолятов C. krusei (MIC GM = 32 и 64 µg/mL) (Espinel-Ingroff и др., 2005). Значение MIC, полученное для масла C. ambrosioides, было ниже, чем сообщают Vasquez и др. (2000) для масла Melaleuca alternifolia (масло чайного дерева) с изолятом C. krusei (8-16 µg/mL). Раствор M. alternifolia использовался в качестве натурального местного антисептика, кроме того, он показал эффективность в лечении устойчивых к флуконазолу Candida в случаях ротоглоточных инфекций у больных СПИДом (Jandourek и др., 1998) и при лечении вагинального кандидоза (Hammer и др., 1998)
Таблица 1. Геометрические средние значения минимальной ингибирующей концентрации (GM-MIC) и ингибирующей концентрации 50 (IC50) эфирных масел и экстрактов с противогрибковым действием
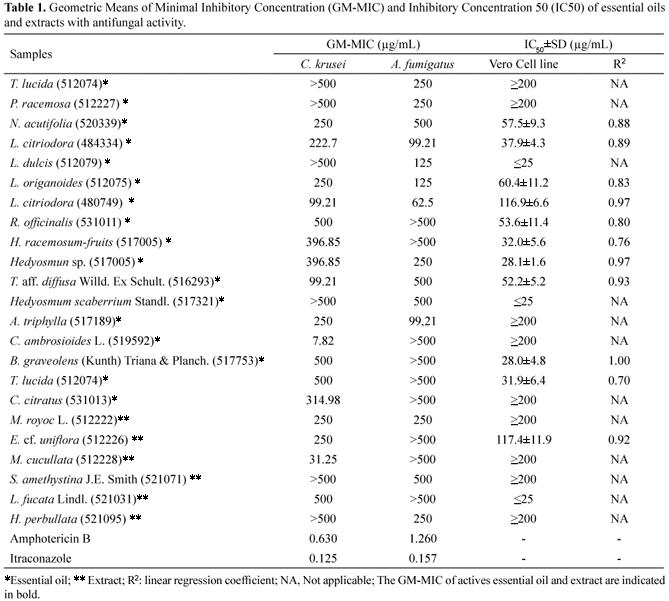
*эфирное масло; ** экстракт; R2: линейный коэффициент регрессии; NA, неприменимый
В Колумбии листья, корни и цветы C. ambrosioides используются как глистогонное антидиарейное средство (Fonnegra & Jimenez, 2007). В данном исследовании, эфирное масло растения этого вида не было активным против A. fumigatus (MIC GM> 500 µg/mL). Однако, масло того же растения, оцененного по технике отравленной еды, полностью ингибировало мицелиальный рост этого волокнистого грибка при 100 µg/mL (Kumar и др., 2007). Это различие противогрибкового действия эфирных масел растений одного вида объясняют хемотип, географическая область сбора, возраст растения, метод экстрагирования масел, метод оценки противогрибкового действия или внутри- или меж-видовые различия (Samaranayake и др., 1995; Cruz и др., 2007; Maksimovic и др., 2008). Sharma & Tripathi (2008) показали, что противогрибковое действие эфирных масел лучше оценивать в жидкой, чем в твердой, среде, так как в последней, гидрофобная природа большинства компонентов эфирного масла препятствует однородному распространению этих веществ в агаровой среде (de Cerqueira и др., 2007).
Химические анализы масла C. ambrosioides были ранее выполнены в нашей лаборатории. Главный компонент масла - терпен аскаридол (31.0 %) (неопубликованные данные). Противогрибковое действие этого терпена ранее было продемонстрировано на Aspergillus flavus, A. glaucus, A. ochraceous, Colletotrichum gloeosporioides, A. niger, C. musae and Fusarium oxysporum (Jardim и др., 2008). Возможно, что воздействие на C. krusei, полученное в этом исследовании, может быть объяснено более высокой концентрацией аскаридола.
H. perbullata - экстракт, имевший лучшее действие против A. fumigatus (MIC GM = 250 µg/mL). Однако, эфирные масла других видов, таких как H. suaveolens и H. ovalifolia, обладают антибактериальным действием против C. albicans и дерматофитов (Asekun и др., 1999; Souza и др., 2003). Экстракты (1) и масла (7) были активны и против C. krusei, и против A. fumigatus; L citriodora был самым активным (MIC GM = 99.21 и 62.5 µg/mL, соответственно). О противогрибковом действии эфирных масел различных видов рода Lippia сообщается, но не о L. citriodora (Oliveira и др., 2007; Hennebelle и др., 2008). Химические анализы масла C. ambrosioides также были сделаны в нашей лаборатории: главными компонентами были гераниаль (18.9 %) и нераль (15.6 %) (неопубликованные данные). Оба вещества были также главными составляющими эфирного масла Thymus pannonicus (41.42 и 29.61 %, соответственно), воздействующего на C. albicans (Maksimovic и др., 2008); следовательно, противогрибковое действие L. citriodora может проистекать из активности этих терпенов. Единственный экстракт, активный против обоих штаммов (MIC GM 250 µg/mL), был получен из M. royoc L. Экстракты других видок, таких как M. elliptica и M. angustifolia проявили отличное биологическое действие, включая противогрибковое (Xiang и др., 2008; Ali и др., 2000). Однако, по нашим сведениям, о противогрибковом действии M. royoc L. не сообщалось.
Критерий цитотоксического действия для неочищенных экстрактов, установленный американским Национальным Онкологическим институтом (США), это IC50 <30 µg/mL (Suffness & Pezzuto, 1990). Согласно этому критерию, эфирным маслам Hedyosmun spp. и L. dulcis считались единственными цитотоксические масла. Это открытие очень важно, благодаря необходимости найти новые противогрибковые соединения с низко-токсическим эффектом.
Важно получить масла и экстракты, активные против C. krusei и A. fumigatus, потому что C. krusei был признан потенциально множественно резистентным патогеном, а A. fumigatus - главная причина инвазивного аспергиллеза у пациентов с ослабленным иммунитетом; кроме того, лишь ограниченное число лекарств доступны для его лечения (Brock и др., 2008, Pfaller и др., 2008). Также, и C. krusei и A. fumigatus имеют способность формировать биоплёнку в биомедицинских устройствах, которые контактируют с кожей, слизистыми или инертными поверхностями (Quindós и др., 2009; Seidler и др., 2008). Предыдущие исследования сообщили о редукции биоплёнок C. albicans эфирными маслами (Agarwal и др., 2008). Поэтому, основываясь на этой информации и наших результатах, возможно применение этих натуральных продуктов, чтобы контролировать формирование биоплёнок.
Динамический процесс времени/уничтожения используется для оценки новых антибактериальных агентов. Это позволяет определить, имеет ли агент фунгистатический или фунгицидный эффект, а также зависимость процесса уничтожения от концентрации или времени (Pfaller и др., 2004). Анализ кривых времени/уничтожения масла C. ambrosioides L. с C. krusei не имел существенного эффекта в 0.5 x и 1 x MIC, тогда как фунгицидный эффект (CFU / mL > 3 зарегистрированные единицы) был обнаружен в 4 x MIC после 4 часов (Рисунок 1a). Это поведение было сопоставимо с эффектом амфотерицина B (Рисунок 1b). Фунгицидное действие клинически важнее, чем фунгистатическое, особенно для больных ВИЧ, потому что профилактическое использование фунгистатических лекарств было связано с увеличением частоты врожденной или приобретенной устойчивости клинических изолятов к лекарствам (Monk & Goffeau, 2008). При 1 x MIC наблюдалось сокращение роста UFC/mL приблизительно в течение 4 часов, с возобновлением роста после 8 часов инкубации. В 24 часа размеры колонии были близки к таковым у контрольной группы. Этот анализ был сделан в сравнении с кривой времени/уничтожения, полученной с амфотерицином B и итраконазолом (Рисунок 1b и Рисунок 1c).
Рисунок 1. Схема времени/уничтожения для (a) масла C. ambrosioides, (b) амфотерицина B и (c) итраконазола против C. krusei
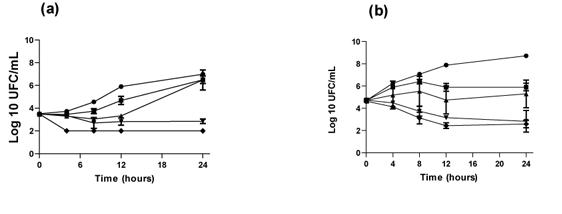
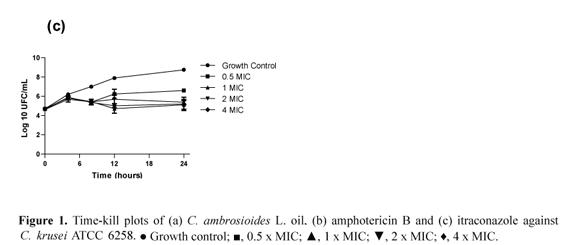
Потенциальная синергия эфирных масел с антибиотиками ранее была рассмотрена с целью увеличить интенсивность уничтожения грибков, сократить продолжительность терапии, избежать возникновения резистентности к лекарствам, расширить спектр действия, и снизить связанную с лекарствами токсичность, позволяя применять более низкие дозы противогрибковых агентов (Shin & Lim, 2004). К сожалению, в этом исследовании был получен индифферентный эффект, когда масло C. ambrosioides L. комбинировали с итраконазолом или амфотерицином B (диапазон FICI = 1.03-1.06 и 1.03-1.00, соответственно).
Исследования, проведенные в нашей лаборатории, показали, что C. krusei более восприимчив к эфирным маслам, чем C. parapsilosis (Mesa-Arango и др., 2007). Samaranayake и др. (1995) продемонстрировал, что C. krusei является более гидрофобным, чем другие виды. Эта физико-химическая особенность могла, по крайней мере частично, объяснить восприимчивость этого грибка к маслам, из-за гидрофобной природы большинства компонентов эфирного масла (de Cerqueira и др., 2007).
В заключение, эфирное масло L. citriodora было образцом с самым широким спектром действия. Кроме того, эфирное масло C. ambrosioides и экстракт M. cucullata ингибировали C. krusei in vitro при тех же концентрациях, что и флуконазол. Также, образцы не были цитотоксическими. Представленные результаты говорят о том, что эти масла и экстракты могут оказаться полезны в разработке новых противогрибковых агентов, и должны стимулировать исследования токсичности, улучшенных формулировок и определения оптимальных концентраций для клинического применения, параллельно с уже применяемыми лекарствами.
Литература
Agarwal V, Lal P, Pruthi V 2008. Prevention of Candida albicans biofilm by plant oils. Mycopathologia 165: 13-19.
Ali AM, Ismail NH, Mackeen MM, Yazan LS, Mohamed SM, Ho AS, Lajis, NH 2000. Antiviral, cyototoxic and antimicrobial activities of anthraquinones isolated from the roots of Morinda elliptica. Pharm Biol 38: 298-301.
Asekun OT, Ekundayo O, Adeniyi BA 1999. Antimicrobial activity of the essential oil of Hyptis suaveolens leaves. Fitoterapia 70: 440-442.
Betancur-Galvis L, Zuluaga C, Arno M, Gonzalez MA, Zaragoza RJ 2002. Cytotoxic effect (on tumor cells) and in vitro antiviral activity against herpes simplex virus of synthetic spongiane diterpenes. J Nat Prod 65: 189-192.
Brock M, Jouvion G, Droin-Bergère S, Dussurget O, Nicola MA, Ibrahim-Granet O 2008. Bioluminescent Aspergillus fumigatus, a new tool for drug efficiency testing and in vivo monitoring of invasive aspergillosis. Appl Environ Microbiol 74: 7023-7035.
Cantón E, Peman J, Valentin A, Bosch M, Espinel-Ingroff A, Gobernado M 2008. Comparison of posaconazole and voriconazole in vitro killing against Candida krusei. Diagn Microbiol Infect Dis 62: 177-181.
Capoor MR, Nair D, Deb M, Verma PK, Srivastava L, Aggarwal P 2005. Emergence of non-Candida albicans species and antifungal resistance in a tertiary care hospital. Jpn J Infect Dis 58: 344-348.
Cavaleiro C, Pinto E, Gonçalves MJ, Salgueiro L 2006. Antifungal activity of Juniperus essential oils against dermatophyte, Aspergillus and Candida strains. J Appl Microbiol 100: 1333-1338.
Cowan MM 1999. Plant products as antimicrobial agents. Clin Microbiol Rev 12: 564-582.
Cruz MC, Santos PO, Barbosa AM Jr, de Mélo DL, Alviano CS, Antoniolli AR, Alviano DS, Trindade RC 2007. Antifungal activity of Brazilian medicinal plants involved in popular treatment of mycoses. J Ethnopharmacol 111: 409-412.
Cuenca-Estrella M, Moore CB, Barchiesi F, Bille J, Chryssanthou E, Denning DW, Donnelly JP, Dromer F, Dupont B, Rex JH, Richardson MD, Sancak B, Verweij PE, Rodriguez-Tudela JL 2003. Multicenter evaluation of the reproducibility of the proposed antifungal susceptibility testing method for fermentative yeasts of the Antifungal Susceptibility Testing Subcommittee of the European Committee on Antimicrobial Susceptibility Testing (AFST-EUCAST). Clin Microbiol Infect 9: 467-474.
de Cerqueira M, Souza-Neta L, Passos M, Lima E, Roque N, Martins D, Guedesc M, Cruz F 2007. Seasonal variation and antimicrobial activity of Myrcia myrtifolia essential oils. J Braz Chem Soc 18: 998-1003.
Espinel-Ingroff A 2008. Mechanisms of resistance to antifungal agents: yeasts and filamentous fungi. Rev Iberoam Micol 25: 101-106.
Espinel-Ingroff A, Barchiesi F, Cuenca-Estrella M, Pfaller MA, Rinaldi M, Rodriguez-Tudela JL, Verweij PE 2005. International and multicenter comparison of EUCAST and CLSI M27-A2 broth microdilution methods for testing susceptibilities of Candida spp. to fluconazole, itraconazole, posaconazole, and voriconazole. J Clin Microbiol 43: 3884-3889.
Fernández-Alonso JL, Rivera-Díaz O 2006. Labiatae. In Ga cía N and Galeano G. Libro Rojo de las Plantas de Colombia 3: Las Bromelias, las Labiadas y las Pasifloras. Bogotá: Colombia Serie Libros Rojos de Especies Amenazadas de Colombia, p. 385-582.
Fonnegra R, Jiménez S 2007. Plantas medicinales aprobadas en Colombia. Medellín: Editorial Universidad de Antioquia.
Haiduven D 2008. Nosocomial aspergillosis and building construction. Med Mycol 25: 1-7.
Hammer KA, Carson CF, Riley TV 1998. In-vitro activity of essential oils, in particular Melaleuca alternifolia (tea tree) oil and tea tree oil products, against Candida spp. J Antimicrob Chemother 42: 591-595.
Hennebelle T, Sahpaz S, Henry J, Bailleul F 2008. Ethnopharmacology of Lippia alba. J Ethnopharmacol 116: 211-222.
Holetz FB, Pessini GL, Sanches NR, Cortez DA, Nakamura CV, Filho BP 2002. Screening of some plants used in the Brazilian folk medicine for the treatment of infectious diseases. Mem Inst Oswaldo Cruz 97: 1027-1031.
Jandourek A, Vaishampayan JK, Vazquez JA 1998. Efficacy of Melaleuca oral solution for the treatment of fluconazole refractory oral candidiasis in AIDS patients. AIDS 12: 1033-1037.
Jardim CM, Jham GN, Dhingra OD, Freire MM 2008. Composition and antifungal activity of the essential oil of the Brazilian Chenopodium ambrosioides L. J Chem Ecol 34: 1213-1218.
Klepser ME, Ernst EJ, Lewis RE, Ernst ME, Pfaller MA 1998. Influence of test conditions on antifungal time-kill curve results: proposal for standardized methods. Antimicrob Agents Chemother 42: 1207-1212.
Kumar R, Mishra AK, Dubey NK, Tripathi YB 2007. Evaluation of Chenopodium ambrosioides oil as a potential source of antifungal, antiaflatoxigenic and antioxidant activity. Int J Food Microbiol 10: 159-164.
Maksimović Z, Milenković M, Vučićević D, Ristić M 2008. Chemical composition and antimicrobial activity of Thymus pannonicus All. (Lamiaceae) essential oil. Cent Eur J Biol 3: 149-154.
Mesa-Arango AM, Montiel J, Bueno J, Betancur-Galvis LA, Durán C, Stashenko E 2007. Evaluación de la activida frente a Candida y Aspergillus de aceites esenciales de plantas del género Lippia. IX Congreso de la Sociedad Española de Quimioterapia y I Congreso Internacional de la Sociedad Iberoamericana de Infectología, Salamanca, España.
Monk BC, Goffeau A 2008. Outwitting multidrug resistance to antifungals. Science 321: 367-369.
National Committee for Clinical Laboratory Standards 2002. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Filamentous Fungi; Approved Standard. Document M38-A. Wayne, USA: National Committee for Clinical Laboratory Standards.
Oliveira DR, Leitao GG, Bizzo HR, Alviano D, Alviano CS, Leitao S 2007. Chemical and antimicrobial analyses of essential oil of Lippia origanoides H.B.K. Food Chemistry 101: 236-240.
Parahitiyawa NB, Samaranayake YH, Samaranayake LP, Ye J, Tsang PW, Cheung BP, Yau JY, Yeung SK 2006. Interspecies variation in Candida biofilm formation studied using the Calgary biofilm device. APMIS 114: 298-306.
Pfaller MA, Messer SA, Boyken L, Rice C, Tendolkar S, Hollis RJ, Diekema DJ 2008. In vitro survey of triazole cross-resistance among more than 700 clinical isolates of Aspergillus species. J Clin Microbiol 46: 2568-2572.
Pfaller MA, Sheehan DJ, Rex JH 2004. Determination of fungicidal activities against yeasts and molds: lessons learned from bactericidal testing and the need for standardization. Clin Microbiol Rev 17: 268-280.
Qiao J, Liu W, Li R 2008. Antifungal resistance mechanisms of Aspergillus. Nippon Ishinkin Gakkai Zasshi 49: 157-163.
Quindós G, Villar-Vidal M, Eraso E 2009. Actividad de la micafungina contra las biopelículas de Candida. Rev Iberoam Micol 26: 49-55.
Samaranayake YH, Wu PC, Samaranayake LP, So M 1995. Relationship between the cell surface hydrophobicity and adherence of Candida krusei and Candida albicans to epithelial and denture acrylic surfaces. APMIS 10: 707-713.
Seidler MJ, Salvenmoser S, Müller FM 2008. Aspergillus fumigatus forms biofilms with reduced antifungal drug susceptibility on bronchial epithelial cells. Antimicrob Agents Chemother 52: 4130-4136.
Sharma N, Tripathi A 2008. Effects of Citrus sinensis (L.) Osbeck epicarp essential oil on growth and morphogenesis of Aspergillus niger (L.) Van Tieghem. Microbiol Res 163: 337-344.
Shin S, Lim S 2004. Antifungal effects of herbal essential oils alone and in combination with ketoconazole against Trichophyton spp. J Appl Microbiol 97: 1289-1296.
Snelders E, van der Lee HA, Kuijpers J, Rijs AJ, Varga J, Samson RA, Mellado E, Donders AR, Melchers WJ, Verweij PE 2008. Emergence of azole resistance in Aspergillus fumigatus and spread of a single resistance mechanism. PLoS Med 11: 1629-1637.
Souza LK, de Oliveira CM, Ferri PH, de Oliveira Júnior JG, de Souza Júnior AH, Fernandes OdeF, Silva Mdo R 2003. Antimicrobial activity of Hyptis ovalifolia towards dermatophytes. Mem Inst Oswaldo Cruz 98: 963- 965.
Stashenko EE, Jaramillo BE, Martinez JR 2004. Comparison of different extraction methods for the analysis of volatile secondary metabolites of Lippia alba (Mill.) N.E. Brown, grown in Colombia, and evaluation of its in vitro antioxidant activity. J Chromatogr A 1025: 93-103.
Suffness M, Pezzuto JM 1990. Assays related to cancer drug discovery. In Hostettmann K. Methods in Plant Biochemistry: Assays for Bioactivity. London: Academic Press, p.71-133.
Tavares AC, Goncalves MJ, Cavaleiro C, Cruz MT, Lopes MC, Canhoto J, Salgueiro LR 2008. Essential oil of Daucus carota subsp. halophilus: composition, antifungal activity and cytotoxicity. J Ethnopharmacol 119: 129-134.
Tempone AG, Sartorelli P, Teixeira D, Prado FO, Calixto IA, Lorenzi H, Melhem MS 2008. Brazilian flora extracts as source of novel antileishmanial and antifungal compounds. Mem Inst Oswaldo Cruz 103: 443-449.
Vazquez JA, Arganoza MT, Boikov D, Akins RA, Vaishampayan JK 2000. In vitro susceptibilities of Candida and Aspergillus species to Melaleuca alternafolia (tea tree) oil. Rev Iberoam Micol 17: 60-63.
Vitale RG, Afeltra J, Dannaoui E 2005. Antifungal combinations. In Antifungal Agents: Methods and Protocols. Totowa, NJ: Humana Press.
Xiang W, Song QS, Zhang HJ, Guo SP 2008. Antimicrobial anthraquinones from Morinda angustifolia. Fitoterapia 79: 501-504.
Источник:
www.scielo.br/scielo.php?scri...lng=en&nrm=iso
Перевод – С.Соболевский
Любое копирование ЗАПРЕЩЕНО!
Похожие статьи
Клетки людей, страдающих акне, могут быть защищены от старения
Ученые из Королевского колледжа в Лондоне обнаружили, что люди, которые
ранее страдали от акне, по всей видимости, имеют более длинные
теломеры в белых кровяных клетках, то есть их клетки могут быть лучше
защищены от старения.
Рекомендуемые товары
1 045р
1 910р
1 150р
350р
520р
880р
1 440р
600р
735р
1 895р
765р
715р
2 925р
735р
1 990р
840р
Теги: ароматерапия, эфирное масло, исследование